- Een beschrijving over corrosieproces, met name gericht op ijzer in een waterige omgeving;
- De mogelijkheden corrosie effectief te bestrijden;
- Praktische consequenties en voorbeelden
Deel 1 Corrosie, iedereen heeft er mee te maken
Ieder jaar leidt onze economie voor enkele miljarden schade door het optreden van corrosie en de gevolgen daarvan. Na verloop van tijd vallen producten spontaan uit elkaar, breken zij af of zijn zodanig aangetast dat het uiterlijk niet meer acceptabel is. Als oldtimer liefhebber is corrosie één van onze gemene vijanden. Menig oldtimer is door corrosie verloren gegaan.

Herkenbaar? In dit geval corrosie in de dorpel van een Morris Minor
Om corrosie effectief te kunnen bestrijden is het nodig enig begrip te hebben van het fenomeen. In dit verhaal wordt eerst uitleg gegeven van het verschijnsel en vervolgens maatregelen besproken corrosie te voorkomen.
Wat is corrosie eigenlijk?
Corrosie wordt omschreven als de destructieve aantasting van een metaal door chemische of elektrochemische reactie met zijn omgeving. Een groot deel van de corrosieverschijnselen, m.n. die in water (of vochtige lucht), bestaat uit elektrochemische reacties. Elektrochemisch wil zeggen dat er tegelijkertijd een elektrische stroom loopt en een chemische reactie plaats vindt. Deze elektrische stroom is heel plaatselijk en kan met speciale middelen zichtbaar worden gemaakt.
Corrosie kan worden ingedeeld in drie hoofdgroepen:
- corrosie in waterige omgeving
- corrosie in niet waterige omgeving zoals bij vloeibare metalen of zouten
- corrosie in gassen of dampen zoals bijvoorbeeld in schoorstenen
Corrosie bij oldtimers heeft voornamelijk te maken met de vorm zoals onder 1. genoemd. In dit verhaal wordt dan ook alleen aandacht gegeven aan corrosie in waterige omgeving. Het corrosieproces in een waterige omgeving is erg complex. Om het verhaal leesbaar en begrijpbaar te houden zal de theorie in eenvoudige termen worden verklaard waarbij de waarheid mogelijk op enkele onderdelen enig geweld wordt aangedaan. De beschrijving vindt plaats aan de hand van het metaal “ijzer” (zeg maar staal), aangezien de carrosserie van de oldtimer voornamelijk van staal is gemaakt en daarbij het corrosieprobleem optreedt.
Het corrosieproces
Een metaal kan (in relatie tot corrosie) op twee manieren voorkomen:
- als atoom dan is het gebonden in het vaste metaal;
- als ion (een geladen deeltje); in dat geval is het metaal opgelost in een vloeistof.
Aangezien we kijken naar corrosie in een waterige omgeving, is de vloeistof dan ook water. Onder invloed van een elektrisch stroompje kan het metaal overgaan van atoom naar ion en omgekeerd. Als het metaal van atoom (gebonden in het metaal) overgaat in de ionvorm gaat er een beetje materiaal aan het oppervlak verloren en spreken we van corrosie.In geval van ijzer gaat het ijzeratoom dus over naar de ionvorm (Fe2+; opgenomen in het water) In onderstaand plaatje wordt dit weergegeven. Bij de overgang wordt een neutraal ijzeratoom een positief geladen deeltje (tweewaardig positief). Bij iedere overgang laat het atoom twee negatief geladen deeltjes (elektronen) achter in het ijzer. Dit kan niet anders omdat het geheel neutraal moet zijn. Als deze overgang maar vaak genoeg gebeurt komen er een heleboel elektronen beschikbaar en vormen samen het elektrische stroompje in het corrosieproces.Water (H2O) bestaat uit waterstofionen en zuurstofionen. De waterstofionen zijn positief geladen (éénwaardig), De zuurstof ionen zijn positief geladen (tweewaardig). Twee waterstof ionen en één zuurstof ion zijn samen neutraal. Twee waterstofionen uit het water nemen graag de vrijgekomen elektronen op. Als dat gebeurt dan gaan de waterstof ionen samen en vormen waterstofgas, dat als belletjes
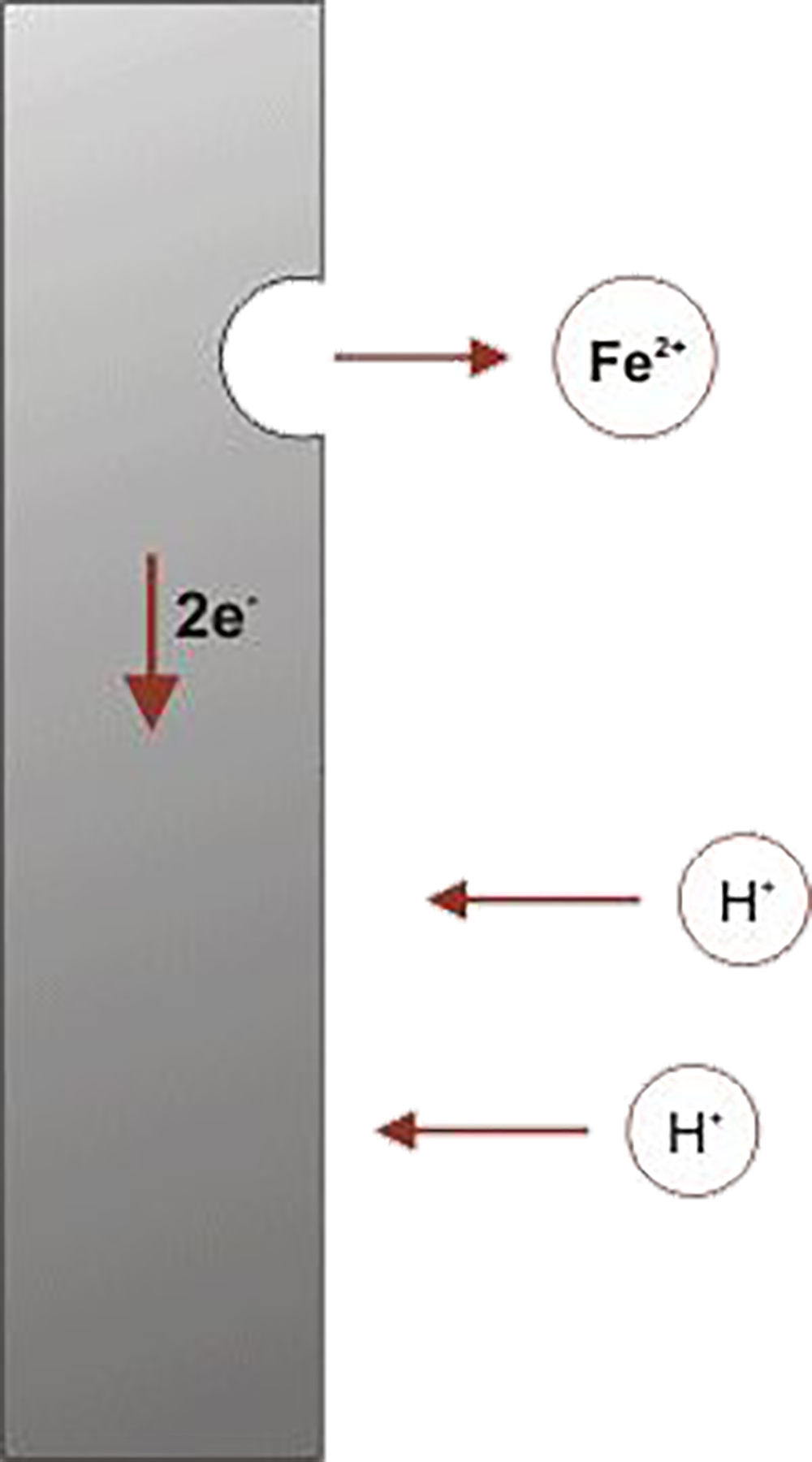
Uit het water ontsnapt.
De overgang van een ijzeratoom naar een ijzerion (in een zure omgeving) Als het ijzerion eenmaal gevormd is verbindt het zich met de aanwezige zuurstofionen tot een ijzeroxide dan wel ijzerhydroxide en heeft het welbekende rood/bruine uiterlijk. De cirkel is op deze manier weer rond. De verklaring van de corrosie gaat er van uit dat in water voldoende waterstofionen aanwezig zijn. In water met een hoge zuurtegraad (lage pH) klopt dit. Bij water met een lage zuurtegraad (hoge pH; basische omgeving) zijn er onvoldoende waterstofionen aanwezig om de corrosie te veroorzaken. Toelichting op het begrip zuurtegraad: de zuurtegraad van leidingwater uit de kraan is neutraal (pH = 7). Als we bij dit water een beetje zuur toevoegen (bv azijnzuur uit moeders kookkast) dan gaat de zuurtegraad naar boven en de pH wordt veel lager dan 7 (bv 2), het water wordt “zuur”. Als we aan het kraanwater loog (bv natronloog; NaOH) toevoegen dan neemt de zuurtegraad af en stijgt de pH sterk (bv 11), Het water wordt “basisch”. IJzer is een bijzonder metaal. Bij ijzer is het ook mogelijk dat bij een lage zuurtegraad (hogere pH) de atomen overgaan in de ionvorm en daarmee corrosie veroorzaken. Om dit proces mogelijk te maken is het nodig dat zuursof in het water is opgelost. De zuurstof heeft een vergelijkbare werking als de waterstof bij een lage pH. Nu we door deze theorie heen zijn kan de uitwerking hiervan aan twee voorbeelden worden geïllustreerd:
Voorbeeld 1
Een centrale verwarming is gemaakt van eenvoudig koolstofstaal (buizen en radiatoren). Leggen we een stalen buis onbeschermd buiten in de regen is deze in kort tijd volledig verroest. In een centrale verwarming is de leiding aan binnenzijn niet verroest! Hoe kan dit? De CV wordt afgevuld met leidingwater. Dit water is neutraal van karakter (niet zuur en niet basisch). Door het water heet te stoken wordt alle opgeloste zuurstof uit het water verdreven. Het resultaat is dat zowel de waterstofreactie als de zuurstofreactie niet meer plaats kan vinden en er dus geen corrosie in een centrale verwarmingssysteem kan ontstaan. Dit is de reden waarom stalen leidingen toegepast kunnen worden. Als er een lekkage is neemt het vrijgekomen water snel zuurstof op en begint aan de buitenkant snel de roestvorming.

De centrale verwarming; aan de binnenzijde geen roest aan de buitenzijde wel roest (door lekkende kraan).
Voorbeeld 2
Zeewater is door de aanwezigheid van zout (NaCl) een sterk corrosieve omgeving. Aangezien de zuurtegraad laag is (pH meestal tussen 7,9 en 8,5) kan de waterstofreactie niet optreden. De corrosie vindt in dat geval plaats op basis van de zuurstofreactie, als er zuurstof aanwezig is. In de “splashzone”, direct aan het wateroppervlak is dit het geval en zal er sterke corrosie optreden. Op grote waterdiepte is er zeer weinig zuurstof aanwezig en kan er dus ook geen corrosie meer plaats vinden. Scheepswrakken worden op de zeebodem zeer weinig aangetast door corrosie.
Het corroderen van ijzer noemen we roesten
Aan de vorming van een bruine corrosielaag op ijzer is de naam roest toegekend. Deze naam is exclusief bedoeld voor ijzer. Aluminium en koper kan dus niet “roesten”, wel corroderen.
Het roesten van ijzer vernielt alles
Het roesten van ijzer (of staal) begint aan het oppervlak. Het corrosieproduct “roest” is poreus en sluit het onderliggende ijzer niet af. De corrosie kan gewoon verder gaan. Als het ijzer over een bepaalde dikte is aangetast kan de corrosie ook onderhuids verder gaan (evenwijdig aan het oppervlak). Dit komt door de gelaagde structuur van het plaatstaal. De gelaagde structuur ontstaat tijdens walsproces in de staalfabriek. Het volume van roest is veel groter dan van het oorspronkelijke staal. Als het staal onderhuids gaat roesten “blaast” de roest het staal van binnen uit op. Hierbij zijn enorme krachten gemoeid. In onderstaande foto is in een blok steen scheurvorming opgetreden door het roesten van de ijzerhoudende aders.

Als de corrosie ongehinderd kan voortgaan wordt uiteindelijk alle ijzer omgezet in roest en valt het materiaal als bladerdeeg uit elkaar.
